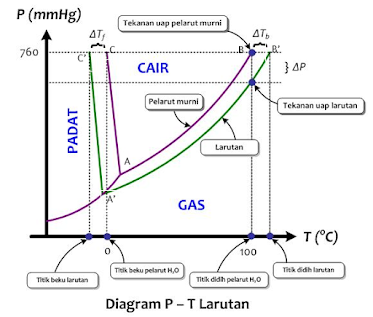
Pada
diagram fasa tersebut terdapat tiga kurva yang membagi diagram ke dalam daerah
padat, cair, dan gas. Pada setiap daerah, menunjukkan keadaan wujud zat yang
stabil.
Pada
tekanan normal (1 atm), pelarut murni air memiliki titik beku 0°C (titik C),
titik didih 100°C (titik B), dan tekanan uap (kurva A – B) yang bergantung pada
suhu. Adanya zat terlarut nonvolatil mengakibatkan pergeseran posisi
kesetimbangan diagram fasa cair-gas.
Titik
beku larutan lebih rendah dari titik beku pelarutnya (titik C'), titik didih
larutan lebih tinggi dibandingkan titik didih pelarutnya (titik B'), dan
tekanan uap turun, ditunjukkan oleh kurva (A' – B'). Demikian pula titik tripel
larutan lebih rendah dari titik tripel air murni.
Nilai
ΔTb dan ΔTd ditunjukkan oleh selisih pergeseran kesetimbangan antara pelarut
murni dan larutannya, yaitu: ΔTb = C – C' dan ΔTd = B' – B. Penurunan tekanan
uap larutan ditunjukkan oleh selisih garis AB – A'B'.
Untuk tambahan
materi, kalian dapat membuka link berikut.
Aplikasi Sifat Koligatif Larutan
Sifat koligatif adalah sifat-sifat
fisis larutan yang hanya bergantung pada konsentrasi partikel zat terlarut,
tetapi tidak pada jenisnya. Sifat koligatif larutan meliputi tekanan uap,
penurunan titik beku, kenaikan titik didih, dan tekanan osmotik. Sifat
koligatif terutama penurunan titik beku dan tekanan osmosis memiliki banyak
kegunaan dalam kehidupan sehari-hari. Beberapa penerapan penurunan titik beku
dapat mempertahankan kehidupan selama musim dingin. Penerapan tekanan osmosis
ditemukan di alam, dalam bidang kesehatan, dan dalam ilmu biologi. Berikut ini
penjelasan mengenai penerapan sifat koligatif larutan dalam kehidupan
sehari-hari.
A. PENERAPAN PENURUNAN TEKANAN UAP
Laut mati adalah contoh dari
terjadinya penurunan tekanan uap pelarut oleh zat terlarut yang tidak mudah
menguap. Air berkadar garam sangat tinggi ini terletak di daerah gurun yang
sangat panas dan kering, serta tidak berhubungan dengan laut bebas, sehingga
konsentrasi zat terlarutnya semakin tinggi.
Kalian juga bisa
mengunjungi video tentang laut mati berikut.
PENERAPAN
PENURUNAN TITIK BEKU
1. Membuat Campuran Pendingin
Cairan pendingin adalah
larutan berair yang memiliki titik beku jauh di bawah 0oC. Cairan
pendingin digunakan pada pabrik es, juga digunakan untuk membuat es putar.
Cairan pendingin dibuat dengan melarutkan berbagai jenis garam ke dalam air.
Pada pembuatan es putar cairan pendingin dibuat dengan mencampurkan garam dapur dengan kepingan es batu dalam sebuah bejana berlapis kayu. Pada pencampuran itu, es batu akan mencair sedangkan suhu campuran turun. Sementara itu, campuran bahan pembuat es putar dimasukkan dalam bejana lain yang terbuat dari bahan stainless steel.
Bejana ini kemudian dimasukkan ke
dalam cairan pendingin, sambil terus-menerus diaduk sehingga campuran membeku.
2.
Antibeku pada Radiator Mobil
Di daerah beriklim dingin, ke dalam air radiator biasanya
ditambahkan etilen glikol. Di daerah beriklim dingin, air radiator mudah membeku.
Jika keadaan ini dibiarkan, maka radiator kendaraan akan cepat rusak. Dengan
penambahan etilen glikol ke dalam air radiator diharapkan titik beku air dalam
radiator menurun, dengan kata lain air tidak mudah membeku.
Cara kerja system pendingin mobil, dapat kalian lihat pada video berikut.
3. Antibeku
untuk Mencairkan Salju
 PENERAPAN KENAIKAN TITIK DIDIH
PENERAPAN KENAIKAN TITIK DIDIHDidunia industri, kenaikan titik didih sangat penting dipelajari
dan dipahami karena pada suatu proses bahan industri perlu diketahui kenaikan
titik didihnya.
1.
Distilasi
Dalam proses distilasi
kita harus mengetahui titik didih tiap senyawa yang dicampur agar waktu yang
diperlukan, kecepatan menguap pada campuran tersebut dapat diketahui. Kenaikan
titik didih juga digunakan untuk mengklasifikasikan bahan bakar yang digunakan
sehari-hari.
2.
Air mendidih
Titik didih zat cair adalah suhu tetap pada saat zat cair mendidih. Pada suhu ini, tekanan uap zat cair sama dengan tekanan udara di sekitarnya. Hal ini menyebabkan terjadinya penguapan di seluruh bagian zat cair. Titik didih zat cair diukur pada tekanan 1 atmosfer. Dari hasil penelitian, ternyata titik didih larutan selalu lebih tinggi dari titik didih pelarut murninya. Hal ini disebabkan adanya partikel – partikel zat terlarut dalam suatu larutan menghalangi peristiwa penguapan partikel – partikel pelarut. Oleh karena itu, penguapan partikel – partikel pelarut membutuhkan energi yang lebih besar. Perbedaan titik didih larutan dengan titik didih pelarut murni disebut kenaikan titik didih. Contohnya air mendidih pada 100 oC.
PENERAPAN TEKANAN OSMOSIS
Mengontrol Bentuk Sel
Larutan-larutan yang mempunyai tekanan osmosis yang sama disebut isotonik. Larutan-larutan yang mempunyai tekanan osmosis lebih rendah daripada larutan lain disebut hipotonik. Sementara itu, larutan-larutan yang mempunyai tekanan osmosis lebih tinggi daripada larutan lain disebut hipertonik. Contoh larutan isotonik adalah cairan infus yang dimasukkan ke dalam darah. Cairan infus harus isotonik dengan cairan intrasel agar tidak terjadi osmosis, baik ke dalam ataupun ke luar sel darah. Dengan demikian, sel-sel darah tidak mengalami kerusakan



Komentar
Posting Komentar